當(dāng)前位置: 經(jīng)濟(jì)學(xué)人 ? 行業(yè)問答
日本處方“神藥”賣到中國,公司社長被捕,什么原因讓“我不是藥神”屢屢上演?
近日,日本一家醫(yī)藥批發(fā)公司將在中國被譽(yù)為“神藥”的日本痛風(fēng)治療藥品售賣到中國,公司社長被捕。
1個(gè)回答
-
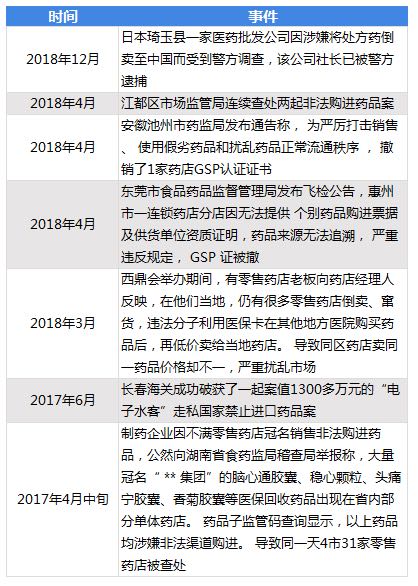
邀請演講2018年12月2日,日本琦玉縣一家醫(yī)藥批發(fā)公司因涉嫌將處方藥倒賣至中國而受到警方調(diào)查,該公司社長已被警方逮捕。事實(shí)上,我國藥品走私、倒賣等違規(guī)案件近年來頻頻發(fā)生,屢禁不止。2018年4月,我國江蘇揚(yáng)州、安徽池州、東莞等多地便發(fā)生了藥店藥品違規(guī)而被查處事件;2017年6月,我國長春海關(guān)緝私局偵破一起價(jià)值1300萬的"電子水客"特大藥品走私案件,海關(guān)現(xiàn)場查扣的國家禁止進(jìn)口藥品共計(jì)303盒;僅上海市自2013年以來已審結(jié)6起海淘洋藥案件,并有多名海淘者獲得不同程度刑罰制裁。圖表1:2017-2018年中國藥品走私、倒賣等違規(guī)事件匯總
 我國之所以藥品走私案件頻發(fā),其背后根本原因是我國目前藥品費(fèi)用高昂,同時(shí)仿制藥產(chǎn)業(yè)發(fā)展緩慢。——新藥研發(fā)周期長、投入高,導(dǎo)致價(jià)格抬高根據(jù)國家衛(wèi)健委數(shù)據(jù),目前,中國已上市抗癌藥品138種,其中進(jìn)口66種,進(jìn)口獨(dú)家27種,2017年總費(fèi)用約1300億元人民幣,近幾年年均增速超過16%,明顯高于世界7%的平均水平。抗癌藥品總體上價(jià)格貴,患者負(fù)擔(dān)重,群眾呼聲高。而抗癌藥物的費(fèi)用之所以如此高昂,背后的重要原因在于新藥的研發(fā)周期很長,投入成本十分高昂。據(jù)悉,藥物研發(fā)分成靶點(diǎn)確認(rèn)、化合物篩選、藥物動(dòng)力學(xué)研究、動(dòng)物實(shí)驗(yàn)、臨床人體實(shí)驗(yàn)五個(gè)階段,其中任何一個(gè)階段出現(xiàn)問題,都會(huì)使藥物的研發(fā)成本不斷升高。一款藥企的新藥從立項(xiàng)到獲批上市要經(jīng)歷5-10年的周期,順利上市非常不容易。圖表2:藥物研發(fā)上市流程
我國之所以藥品走私案件頻發(fā),其背后根本原因是我國目前藥品費(fèi)用高昂,同時(shí)仿制藥產(chǎn)業(yè)發(fā)展緩慢。——新藥研發(fā)周期長、投入高,導(dǎo)致價(jià)格抬高根據(jù)國家衛(wèi)健委數(shù)據(jù),目前,中國已上市抗癌藥品138種,其中進(jìn)口66種,進(jìn)口獨(dú)家27種,2017年總費(fèi)用約1300億元人民幣,近幾年年均增速超過16%,明顯高于世界7%的平均水平。抗癌藥品總體上價(jià)格貴,患者負(fù)擔(dān)重,群眾呼聲高。而抗癌藥物的費(fèi)用之所以如此高昂,背后的重要原因在于新藥的研發(fā)周期很長,投入成本十分高昂。據(jù)悉,藥物研發(fā)分成靶點(diǎn)確認(rèn)、化合物篩選、藥物動(dòng)力學(xué)研究、動(dòng)物實(shí)驗(yàn)、臨床人體實(shí)驗(yàn)五個(gè)階段,其中任何一個(gè)階段出現(xiàn)問題,都會(huì)使藥物的研發(fā)成本不斷升高。一款藥企的新藥從立項(xiàng)到獲批上市要經(jīng)歷5-10年的周期,順利上市非常不容易。圖表2:藥物研發(fā)上市流程

——印度成為"世界藥房",而我國仿制藥產(chǎn)業(yè)發(fā)展不足目前,印度憑借著其仿制藥的價(jià)格低廉和穩(wěn)定可靠地質(zhì)量,成為全球最大的仿制藥生產(chǎn)大國,為世界200多個(gè)多家出口藥物。數(shù)據(jù)顯示,全球20%的仿制藥都來自印度,疫苗和生物制藥產(chǎn)品出口到150個(gè)國家。更值得一提的是,印度仿制藥的60%以上是出口到美歐日等發(fā)達(dá)國家的,其中美國市場上近四成的仿制藥品都來自印度。根據(jù)印度政府官網(wǎng)數(shù)據(jù),印度有超過500家經(jīng)過美國FDA認(rèn)證的制藥工廠,印度出口數(shù)據(jù)顯示,從2012年至2016年,出口總額由101億美元增長至169億,年復(fù)合增長率13.73%。從出口國家占比來看,美國是印度總體藥品的主要出口市場,2017年占印度總體出口的38%,2016年醫(yī)藥出口占印度全國出口總額4.9%。圖表3:2017年印度醫(yī)藥出口國家分布(單位:%)

與印度相比,我國仿制藥無論在價(jià)格上或是質(zhì)量上都難以相提并論。一方面,我國仿制藥質(zhì)量與原研藥差距較大;另一方面,我國仿制藥市場良莠不齊,重復(fù)申報(bào)、數(shù)量過多等問題嚴(yán)重。此外,中國藥品生產(chǎn)廠商的工藝、流程、質(zhì)量控制等關(guān)鍵環(huán)節(jié)漏洞較多,監(jiān)管機(jī)構(gòu)對于藥品認(rèn)證的標(biāo)準(zhǔn)與國際標(biāo)準(zhǔn)差距較大,執(zhí)行力度也不足,這些因素都導(dǎo)致中國仿制藥難以得到業(yè)界認(rèn)可。
針對我國醫(yī)藥費(fèi)用高昂,藥品監(jiān)管不嚴(yán)等問題,國家已經(jīng)積極開展各項(xiàng)措施,力圖大力降低醫(yī)藥費(fèi)用,加強(qiáng)醫(yī)藥監(jiān)管。——39個(gè)國家藥品談判品種已平均降價(jià)50%以上 2016年以來,原國家衛(wèi)生計(jì)生委、人力資源和社會(huì)保障部就分別組織開展了國家藥品價(jià)格談判和國家醫(yī)保目錄談判,39個(gè)談判品種平均降價(jià)50%以上,處于全球低價(jià)位水平。——加強(qiáng)監(jiān)管,完善仿制藥管理政策的指導(dǎo)性文件 為使我國仿制藥發(fā)展提速,2017年國務(wù)院確定的2017年醫(yī)改重點(diǎn)任務(wù)重,明確提出要完成制定改革完善仿制藥管理政策的指導(dǎo)性文件。2017年1月,國務(wù)院下發(fā)《關(guān)于進(jìn)一步改革完善藥品生產(chǎn)流通使用政策的若干意見》,強(qiáng)調(diào)要加快推進(jìn)已上市仿制藥質(zhì)量和療效一致性評價(jià)。《意見》中談到,鼓勵(lì)藥品生產(chǎn)企業(yè)按相關(guān)指導(dǎo)原則主動(dòng)選購參比制劑,合理選用評價(jià)方法,開展研究和評價(jià)。對需進(jìn)口的參比制劑,加快進(jìn)口審批,提高通關(guān)效率。對生物等效性試驗(yàn)實(shí)行備案制管理,允許具備條件的醫(yī)療機(jī)構(gòu)、高等院校、科研機(jī)構(gòu)和其他社會(huì)辦檢驗(yàn)檢測機(jī)構(gòu)等依法開展一致性評價(jià)生物等效性試驗(yàn)。附:39種國家談判藥品完整目錄圖表4:39種國家談判藥品目錄整理(一)
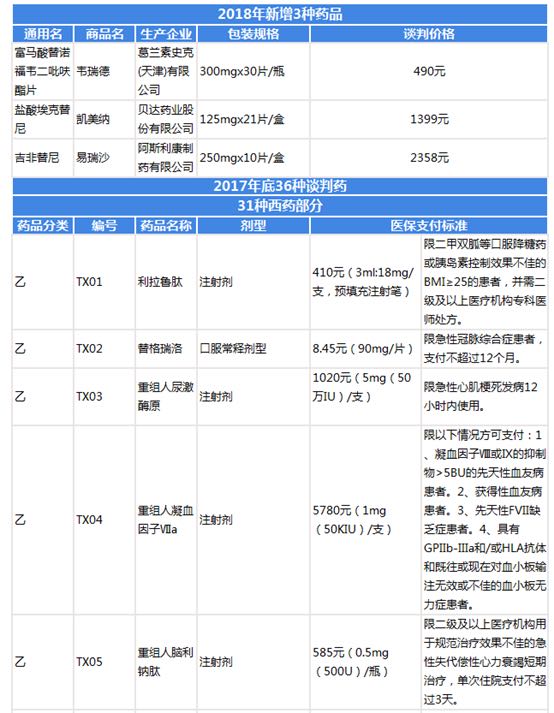
圖表5:39種國家談判藥品目錄整理(二)
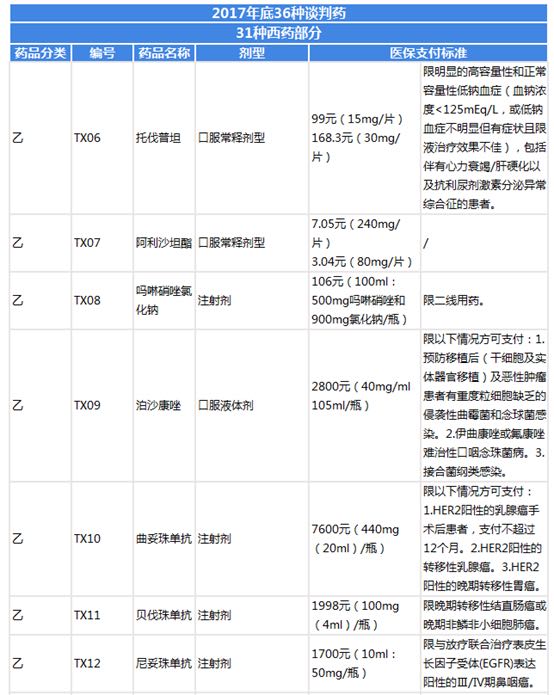
圖表6:39種國家談判藥品目錄整理(三)
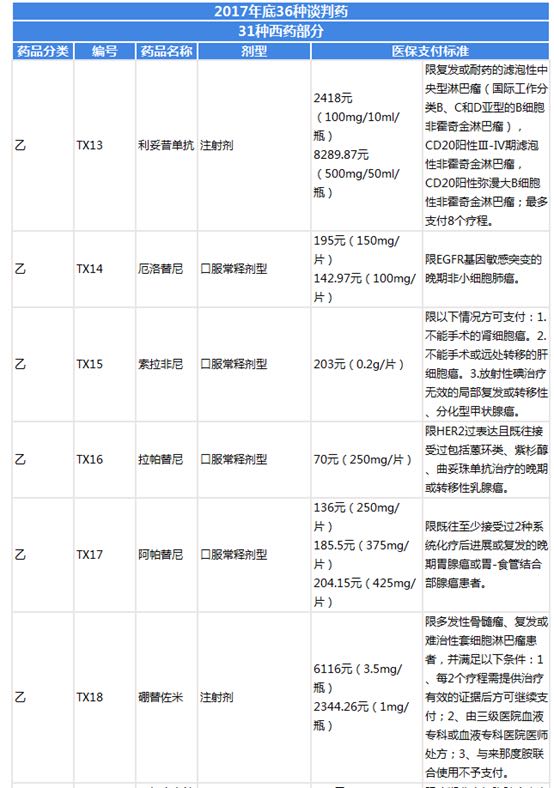
圖表7:39種國家談判藥品目錄整理(四)

圖表8:39種國家談判藥品目錄整理(五)

圖表9:39種國家談判藥品目錄整理(六)

掃一掃
下載《前瞻經(jīng)濟(jì)學(xué)人APP》進(jìn)行提問
與資深行業(yè)研究員/經(jīng)濟(jì)學(xué)家互動(dòng)交流讓您成為更懂行業(yè)的人






























